- May -akda Alex Aldridge [email protected].
- Public 2023-12-17 13:52.
- Huling binago 2025-06-01 07:38.
Ang pangunahing pagkakaiba sa pagitan ng carbonic acid at bicarbonate ay ang carbonic acid ay isang neutral na chemical compound, samantalang ang bicarbonate ay isang negative charged chemical compound.
Carbonic acid ay isang mahinang acid na nabubuo sa solusyon kapag ang carbon dioxide ay natunaw sa tubig, na may kemikal na formula na H2CO3. Ang bicarbonate ay nabubuo sa pamamagitan ng kumbinasyon ng tatlong oxygen atoms, isang hydrogen atom, at isang carbon atom na may chemical formula na HCO3-.
Ano ang Carbonic Acid?
Carbonic acid ay H2CO3. Minsan, ibinibigay namin ang pangalang ito sa mga solusyon na may carbon dioxide na natunaw sa tubig o carbonated na tubig. Ito ay dahil ang carbonated na tubig ay naglalaman ng isang maliit na halaga ng H2CO3. Higit pa rito, ang carbonic acid ay isang mahinang acid, at maaari itong bumuo ng dalawang uri ng mga asin bilang carbonates at bicarbonates. Ang molar mass ng tambalang ito ay 62.024 g/mol.
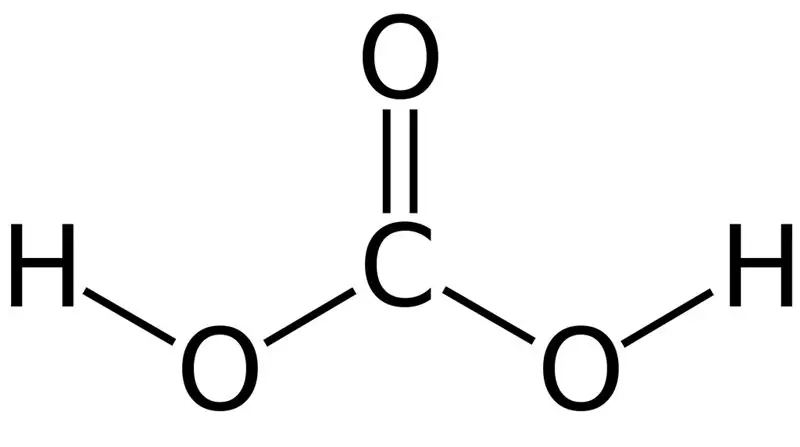
Figure 01: Ang Chemical Structure ng Carbonic Acid
Kapag natunaw ang carbon dioxide sa tubig, pumapasok ito sa equilibrium sa pagitan ng carbon dioxide at carbonic acid. Ang equilibrium ay ang mga sumusunod:
CO2 + H2O ⟷ H2CO3
Kung magdaragdag tayo ng labis na carbonic acid sa isang base, nagbibigay ito ng bicarbonate. Ngunit, kung mayroong labis na base, ang carbonic acid ay may posibilidad na magbigay ng mga carbonated na asing-gamot. Mas tiyak, ang carbonic acid ay isang carboxylic acid compound na mayroong dalawang hydroxyl group substituents na nakakabit sa carbonyl carbon. Bukod dito, ito ay isang polyprotic acid, na may kakayahang mag-donate ng mga proton. Mayroon itong dalawang naaalis na proton, kaya ito ay partikular na diprotik.
Ano ang Bicarbonate?
Nabubuo ang bicarbonate sa pamamagitan ng kumbinasyon ng tatlong oxygen atoms, isang hydrogen atom, at isang carbon atom. Ang produkto ng kumbinasyong ito ay maaaring isang ion o isang tambalang may mas maraming electron kaysa sa mga proton. Maaari naming ilarawan ito bilang isang kemikal na species na mayroong chemical formula na HCO3-.
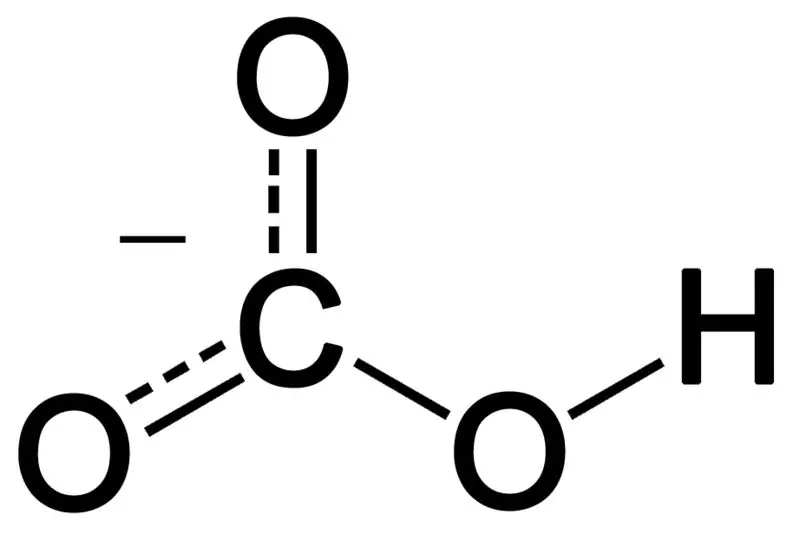
Figure 02: Ang Chemical Structure ng Bicarbonate Anion
Ang tambalang ito ay isang mahalagang bahagi ng pH buffering system ng katawan, sa mga karaniwang termino: responsable ito sa pagpapanatili ng dugo sa isang estado na hindi masyadong acidic o masyadong basic. Bilang karagdagan, ito ay nagsisilbing isang paraan ng pag-iwas sa digestive juice sa sandaling natapos na ng tiyan ang pagtunaw ng pagkain. Higit pa rito, ang carbonic acid sa tubig-ulan ay bumubuo ng mga bicarbonate ions kapag tumama ito sa mga bato. Ang daloy ng mga bicarbonate ions na ito ay mahalaga sa pagpapanatili ng siklo ng carbon.
Ano ang Pagkakaiba sa pagitan ng Carbonic Acid at Bicarbonate?
Carbonic acid ay isang mahinang acid na nabubuo sa solusyon kapag ang carbon dioxide ay natunaw sa tubig, at ang kemikal na formula nito ay H2CO3. Ang bikarbonate ay nabubuo sa pamamagitan ng kumbinasyon ng tatlong oxygen atoms, isang hydrogen atom, at isang carbon atom na may chemical formula na HCO3-. Ang pangunahing pagkakaiba sa pagitan ng carbonic acid at bicarbonate ay ang carbonic acid ay isang neutral na compound ng kemikal, samantalang ang bicarbonate ay isang negatibong sisingilin na kemikal na compound. Bukod dito, ginagamit ang carbonic acid sa paggawa ng mga bubbly, fizzy na inumin, paggamot sa dermatitides, sa mouthwash, atbp., habang ang bikarbonate ay ginagamit sa paghahanda ng pagkain tulad ng baking (bilang isang pampaalsa), at nagbibigay ito ng kakayahang labanan ang mga pagbabago sa pH.
Ang sumusunod na infographic ay nagbubuod ng pagkakaiba sa pagitan ng carbonic acid at bicarbonate sa tabular form para sa magkatabi na paghahambing.
Buod - Carbonic Acid vs Bicarbonate
Carbonic acid ay H2CO3. Ang bikarbonate ay nabubuo sa pamamagitan ng kumbinasyon ng tatlong oxygen atoms, isang hydrogen atom at isang carbon atom, na may kemikal na formula HCO3-. Ang pangunahing pagkakaiba sa pagitan ng carbonic acid at bicarbonate ay ang carbonic acid ay isang neutral na compound ng kemikal, samantalang ang bicarbonate ay isang negatibong sisingilin na kemikal na compound.






